Как определить щелочную нейтральную и кислую среды
Конспект урока с презентацией по естествознанию на тему»Среда водных растворов электролитов. Уровень Ph.»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Выберите документ из архива для просмотра:
Выбранный для просмотра документ правила. docx Первая строчка — записывается одно слово – существительное. Это и есть тема синквейна.
Вторая строчка — пишутся два прилагательных, раскрывающих тему синквейна.
Третья строчка — записываются три глагола, описывающих действия, относящиеся к теме синквейна.
Четвёртая строчка – здесь размещается целая фраза, предложение, состоящее из нескольких слов, с помощью которого автор характеризует тему в целом, высказывает свое отношение к теме.
Пятая строчка – это слово-резюме, которое дает новую интерпретацию темы, выражает личное отношение автора к теме. Первая строчка — записывается одно слово – существительное. Это и есть тема синквейна.
Вторая строчка — пишутся два прилагательных, раскрывающих тему синквейна.
Третья строчка — записываются три глагола, описывающих действия, относящиеся к теме синквейна.
Четвёртая строчка – здесь размещается целая фраза, предложение, состоящее из нескольких слов, с помощью которого автор характеризует тему в целом, высказывает свое отношение к теме.
Пятая строчка – это слово-резюме, которое дает новую интерпретацию темы, выражает личное отношение автора к теме. Первая строчка — записывается одно слово – существительное. Это и есть тема синквейна.
Вторая строчка — пишутся два прилагательных, раскрывающих тему синквейна.
Третья строчка — записываются три глагола, описывающих действия, относящиеся к теме синквейна.
Четвёртая строчка – здесь размещается целая фраза, предложение, состоящее из нескольких слов, с помощью которого автор характеризует тему в целом, высказывает свое отношение к теме.
Пятая строчка – это слово-резюме, которое дает новую интерпретацию темы, выражает личное отношение автора к теме.  Курс повышения квалификации
Курс повышения квалификации
Специальная оценка условий труда
 Курс повышения квалификации
Курс повышения квалификации
Методики библиотечно-консультационной работы с различными категориями пользователей: юношеством, лицами с ограниченными возможностями здоровья в условиях реализации ФГОС
 Курс повышения квалификации
Курс повышения квалификации
Охрана труда
Сейчас обучается 111 человек из 46 регионов 
«Кубанская свадьба»
Выбранный для просмотра документ практическая. docx Практическая работа №2 « Определение реакции среды растворов солей при гидролизе» Оборудование и реактивы: лосьон для очистки лица, лимон, раствор туалетного мыла, раствор стирального порошка, универсальный индикатор ( полоски бумаги), лабораторные пробирки. Цель: рассмотреть количественные характеристики кислотной, щелочной и кислой сред водных растворов, исследовать изменение окраски сока краснокочанной капусты в кислотной и щелочной средах. ЗАДАНИЕ ЧАСТИ «А» Ход опыта: приготовьте растворы питьевой соды ( NaHCO 3 ), туалетного мыла ( C 17 H 35 COONa ), стирального порошка ( Na 2 CO 3 10 H 2 O ),. Определите значение рН и реакцию среды, помещая полоски индикаторной бумаги в исследуемую жидкость и сравнивая окраску полоски с эталонной шкалой. Результаты опытов запишите в таблицу: Изменение цвета индикатора Среда раствора ( кислотная, щелочная, нейтральная) ЗАДАНИЕ ЧАСТИ «В» Ответьте на вопросы: 1)Почему не рекомендуется для частого умывания лица использовать мыло? 2) Для какой цели во все лосьоны для очистки кожи лица обязательно добавляют слабые кислоты? 3) Запишите уравнение гидролиза питьевой соды, мыла туалетного, аммиачной селитры, сделайте вывод, какими кислотами и щелочами (сильными или слабыми) образованы эти соли, определите, по катиону или аниону идет гидролиз. Выбранный для просмотра документ присматривайтесь. pptx  Рабочие листы и материалы для учителей и воспитателей Более 2 500 дидактических материалов для школьного и домашнего обучения
Рабочие листы и материалы для учителей и воспитателей Более 2 500 дидактических материалов для школьного и домашнего обучения
Описание презентации по отдельным слайдам:
 Присматривайтесь к сорнякам, и они вам совершенно точно подскажут, где и какая у вас почва
Присматривайтесь к сорнякам, и они вам совершенно точно подскажут, где и какая у вас почва  Опреление кислотности почвы. Кислые — конский щавель, полевой хвощ, трехцветная фиалка, дикая мята.
Опреление кислотности почвы. Кислые — конский щавель, полевой хвощ, трехцветная фиалка, дикая мята.  Слабокислые — мать-и-мачеха, ромашка, пырей, одуванчик, сныть, клевер, папоротники.
Слабокислые — мать-и-мачеха, ромашка, пырей, одуванчик, сныть, клевер, папоротники.  Нейтральные — пастушья сумка, лебеда, крапива, мокрица.
Нейтральные — пастушья сумка, лебеда, крапива, мокрица.  Слабощелочные — мак, вьюнок, дрема белая.
Слабощелочные — мак, вьюнок, дрема белая.  Легкая песчаная почва — горец вьющийся, липучка ежевидная, метелица полевая. Сухая почва — полынь горькая, щирица запрокинутая, липучка ежевидная. Засоленная почва — солянка русская.
Легкая песчаная почва — горец вьющийся, липучка ежевидная, метелица полевая. Сухая почва — полынь горькая, щирица запрокинутая, липучка ежевидная. Засоленная почва — солянка русская.  Точно определить кислотность можно с помощью лакмусовых полосок. Самое сложное это найти и приобрести эти полоски. Пишут, что их можно найти в аптеках и в магазинах, торгующих оборудованием для аквариумов, салонов красоты и мыловарения. Выбранный для просмотра документ урок. docx Среда водных растворов электролитов. Уровень Ph . урок естествознания в 114 группе Составил преподаватель физики ОГБОУ СПО «Шарьинский политехнический техникум»: Возненко Оксана Викторовна Цель: формирование исследовательской компетенции обучающихся при изучении среды водных растворов электролитов и методов ее качественного анализа. сформировать представление обучающихся о типах среды водных растворов (кислая, нейтральна, щелочная); рассмотреть понятие «индикаторы» изучить изменение окраски индикаторов в разных средах; проанализировать зависимость между средой раствора и значением водородного показателя; сформировать навыки работы обучающихся с универсальным индикатором; Форма: урок – исследование . Данная форма позволяет моделировать все этапы химического исследования при изучении конкретной темы. На подготовительном этапе часть студентов группы получают индивидуальные задания для подготовки творческих отчетов на уроке. На данном уроке гармонично сочетаются проблемный метод и химический эксперимент, служащий средством доказательства или опровержения выдвинутых гипотез. Ведущая форма деятельности на уроке – самостоятельная работа обучающихся в парах, выполняющих одинаковые задания.. I этап — мотивационный Вступительная беседа: Мир, окружающий нас, полон разнообразных по строению и свойствам веществ. Познание их позволит нам познать самих себя. Самым оптимальным и емким способом познания является исследование. Сегодня я предлагаю нам представить себя не учениками и учителем, а сотрудниками серьезной лаборатории, маститыми учеными-исследователями химии. Для начала позвольте мне задать Вам вопрос, который был адресован мне одним из учеников: «Сегодня с экранов телевизора мы постоянно слышим об уровне Ph. Что это за зверь такой, и к чему мне обычному студенту такие познания в химии?» Обсуждение вариантов ответа. (Соотношение кислоты и щелочи в каком-либо растворе называется кислотно-щелочным равновесием, оно характеризуется специальным показателем pH (power Hidrogen – “сила водорода”), который показывает число водородных атомов в данном растворе) Цель нашего сегодняшнего исследования: вспомнить все, что мы знаем об уровне Ph и изучить некоторые способы качественного анализа водных Полемика: Какими способами можно воспользоваться? (Можно проводить химические реакции – качественные реакции, доказывающие наличие в растворе тех или иных частиц.) А можно воспользоваться специальными веществами – индикаторами. Вопрос для размышления: Вы знакомы с индикаторами из курса биологии, физики и других учебных дисциплин. Как Вы думаете, какое значение в химии имеет термин «индикатор»? ( Индикатор – это вещество, изменяющее свой цвет в зависимости от среды раствора ) Вопрос для размышления: Что такое «среда раствора»? Какая она бывает? Итак, мы выяснили, что существуют три типа среды водных растворов (кислая, нейтральная и щелочная). Измерить уровень кислотности водной среды нам помогут индикаторы, о которых мы уже говорили вначале урока. Индикаторы бывают разные. Сегодня мы с Вами познакомимся с индикатором для определения кислотности почвы и растворов в виде тест-полосок Практическая работа И так, мы с вами вспомнили, что такое уровень Ph, попробовали определить его при помощи индикаторов. Осталось выяснить для чего нам необходимы эти знания в повседневной жизни. Выступление творческих групп Проблемные вопросы: Как Вы думаете, какие жидкости не рекомендуется употреблять людям с язвенной болезнью желудка? Почему? (Все слабо — и сильно кислые растворы (кофе, лимонный, яблочный, томатный сок, Кока-кола) могут вызвать обострение язвенной болезни из-за излишний кислотности). Что общего, на Ваш взгляд, между нашатырным спиртом, который хозяйки добавляют в воду для мытья стекол, и мылом, которым мы с Вами моем руки? (И раствор мыла, и нашатырный спирт имеют щелочную среду, которая способствует удалению грязи). Рефлексия Еще раз отвечаем на вопрос студента Д/з Оформить работу, ответить на вопросы уровня «В», написать синквейн
Точно определить кислотность можно с помощью лакмусовых полосок. Самое сложное это найти и приобрести эти полоски. Пишут, что их можно найти в аптеках и в магазинах, торгующих оборудованием для аквариумов, салонов красоты и мыловарения. Выбранный для просмотра документ урок. docx Среда водных растворов электролитов. Уровень Ph . урок естествознания в 114 группе Составил преподаватель физики ОГБОУ СПО «Шарьинский политехнический техникум»: Возненко Оксана Викторовна Цель: формирование исследовательской компетенции обучающихся при изучении среды водных растворов электролитов и методов ее качественного анализа. сформировать представление обучающихся о типах среды водных растворов (кислая, нейтральна, щелочная); рассмотреть понятие «индикаторы» изучить изменение окраски индикаторов в разных средах; проанализировать зависимость между средой раствора и значением водородного показателя; сформировать навыки работы обучающихся с универсальным индикатором; Форма: урок – исследование . Данная форма позволяет моделировать все этапы химического исследования при изучении конкретной темы. На подготовительном этапе часть студентов группы получают индивидуальные задания для подготовки творческих отчетов на уроке. На данном уроке гармонично сочетаются проблемный метод и химический эксперимент, служащий средством доказательства или опровержения выдвинутых гипотез. Ведущая форма деятельности на уроке – самостоятельная работа обучающихся в парах, выполняющих одинаковые задания.. I этап — мотивационный Вступительная беседа: Мир, окружающий нас, полон разнообразных по строению и свойствам веществ. Познание их позволит нам познать самих себя. Самым оптимальным и емким способом познания является исследование. Сегодня я предлагаю нам представить себя не учениками и учителем, а сотрудниками серьезной лаборатории, маститыми учеными-исследователями химии. Для начала позвольте мне задать Вам вопрос, который был адресован мне одним из учеников: «Сегодня с экранов телевизора мы постоянно слышим об уровне Ph. Что это за зверь такой, и к чему мне обычному студенту такие познания в химии?» Обсуждение вариантов ответа. (Соотношение кислоты и щелочи в каком-либо растворе называется кислотно-щелочным равновесием, оно характеризуется специальным показателем pH (power Hidrogen – “сила водорода”), который показывает число водородных атомов в данном растворе) Цель нашего сегодняшнего исследования: вспомнить все, что мы знаем об уровне Ph и изучить некоторые способы качественного анализа водных Полемика: Какими способами можно воспользоваться? (Можно проводить химические реакции – качественные реакции, доказывающие наличие в растворе тех или иных частиц.) А можно воспользоваться специальными веществами – индикаторами. Вопрос для размышления: Вы знакомы с индикаторами из курса биологии, физики и других учебных дисциплин. Как Вы думаете, какое значение в химии имеет термин «индикатор»? ( Индикатор – это вещество, изменяющее свой цвет в зависимости от среды раствора ) Вопрос для размышления: Что такое «среда раствора»? Какая она бывает? Итак, мы выяснили, что существуют три типа среды водных растворов (кислая, нейтральная и щелочная). Измерить уровень кислотности водной среды нам помогут индикаторы, о которых мы уже говорили вначале урока. Индикаторы бывают разные. Сегодня мы с Вами познакомимся с индикатором для определения кислотности почвы и растворов в виде тест-полосок Практическая работа И так, мы с вами вспомнили, что такое уровень Ph, попробовали определить его при помощи индикаторов. Осталось выяснить для чего нам необходимы эти знания в повседневной жизни. Выступление творческих групп Проблемные вопросы: Как Вы думаете, какие жидкости не рекомендуется употреблять людям с язвенной болезнью желудка? Почему? (Все слабо — и сильно кислые растворы (кофе, лимонный, яблочный, томатный сок, Кока-кола) могут вызвать обострение язвенной болезни из-за излишний кислотности). Что общего, на Ваш взгляд, между нашатырным спиртом, который хозяйки добавляют в воду для мытья стекол, и мылом, которым мы с Вами моем руки? (И раствор мыла, и нашатырный спирт имеют щелочную среду, которая способствует удалению грязи). Рефлексия Еще раз отвечаем на вопрос студента Д/з Оформить работу, ответить на вопросы уровня «В», написать синквейн
Кислая среда и щелочная среда: определение и свойства. Ph-тест
Кислоты и щелочи — два крайних положения одной шкалы: их свойства (совершенно противоположные) обусловливает одна и та же величина — концентрация ионов водорода (H+). Однако само по себе это число очень неудобное: даже в кислых средах, где концентрация ионов водорода выше, это число составляет сотые, тысячные доли единицы. Поэтому для удобства пользуются десятичным логарифмом этого значения, умноженным на минус один. Принято говорить, что это pH (potentia Hydrogen), или же водородный показатель.
Возникновение понятия
Вам будет интересно: Какие свойства воздуха использует костер? Или все-таки люди, его разжигая? Вообще тот факт, что кислая среда и щелочная среда определяются концентрацией ионов водорода H+ и что чем выше их концентрация, тем раствор более кислый (и наоборот, чем ниже концентрация H+, тем более щелочная среда и выше концентрация противоположных ионов OH-), был известен науке достаточно давно. Однако лишь в 1909 году датский химик Серенсен впервые опубликовал исследования, в которых пользовался понятием водородного показателя — PH, впоследствии замененным на pH.
Расчет кислотности
 При расчете водородного показателя исходят из того, что молекулы воды в растворе, хоть и в очень малых количествах, все же диссоциируют на ионы. Эта реакция называется автопротолизом воды: Вам будет интересно: Термин таймшит. Таймшит — это. Реакция обратима, поэтому для нее определена константа равновесия (показывающая, какие в среднем устанавливаются концентрации каждого компонента). Здесь дано значение константы для стандартных условий — температуры 22 °С. Внизу в квадратных скобках — молярные концентрации указанных компонентов. Молярная концентрация воды в воде — приблизительно 55 моль/литр, то есть величина второго порядка. Следовательно, произведение концентраций ионов H+ и OH — — около 10-14. Эта величина называется ионным произведением воды. В чистой воде концентрации ионов водорода и гидроксид-ионов равны 10-7. Соответственно, водородный показатель воды будет приблизительно 7. Это значение pH принимают за нейтральную среду.
При расчете водородного показателя исходят из того, что молекулы воды в растворе, хоть и в очень малых количествах, все же диссоциируют на ионы. Эта реакция называется автопротолизом воды: Вам будет интересно: Термин таймшит. Таймшит — это. Реакция обратима, поэтому для нее определена константа равновесия (показывающая, какие в среднем устанавливаются концентрации каждого компонента). Здесь дано значение константы для стандартных условий — температуры 22 °С. Внизу в квадратных скобках — молярные концентрации указанных компонентов. Молярная концентрация воды в воде — приблизительно 55 моль/литр, то есть величина второго порядка. Следовательно, произведение концентраций ионов H+ и OH — — около 10-14. Эта величина называется ионным произведением воды. В чистой воде концентрации ионов водорода и гидроксид-ионов равны 10-7. Соответственно, водородный показатель воды будет приблизительно 7. Это значение pH принимают за нейтральную среду.  Далее нужно отвлечься от воды и рассмотреть раствор какой-нибудь кислоты или щелочи. Возьмем, например, уксусную кислоту. Ионное произведение воды останется прежним, однако баланс между ионами H+ и OH — сместится в сторону первых: ионы водорода придут от частично продиссоциировавшей уксусной кислоты, а «лишние» гидроксид-ионы уйдут в недиссоциировавшие молекулы воды. Таким образом, концентрация ионов водорода будет выше, и pH будет меньше (не надо забывать, что логарифм берется со знаком «минус»). Соответственно, кислая среда и щелочная среда связаны с pH. И связаны следующим образом. Чем меньше значение водородного показателя, тем более кислая среда.
Далее нужно отвлечься от воды и рассмотреть раствор какой-нибудь кислоты или щелочи. Возьмем, например, уксусную кислоту. Ионное произведение воды останется прежним, однако баланс между ионами H+ и OH — сместится в сторону первых: ионы водорода придут от частично продиссоциировавшей уксусной кислоты, а «лишние» гидроксид-ионы уйдут в недиссоциировавшие молекулы воды. Таким образом, концентрация ионов водорода будет выше, и pH будет меньше (не надо забывать, что логарифм берется со знаком «минус»). Соответственно, кислая среда и щелочная среда связаны с pH. И связаны следующим образом. Чем меньше значение водородного показателя, тем более кислая среда.
Свойства кислой среды
Кислая среда — это растворы с pH меньше 7. Следует оговориться, что, хотя значение ионного произведения воды на первый взгляд ограничивает значения водородного показателя в пределах от 1 до 14, на самом деле растворы с pH меньше единицы (и даже меньше нуля) и больше 14 существуют. Например, в концентрированных растворах сильных кислот (серной, соляной) pH может достигать -2. От того, имеем ли мы кислую среду или среду щелочную, может зависеть растворимость некоторых веществ. Например, возьмем гидроксиды металлов. Растворимость определяется величиной произведения растворимости, которое по структуре есть то же, что и ионное произведение воды: перемноженные концентрации. В случае с гидроксидом в произведение растворимости входит концентрация иона металла и концентрация гидроксид-ионов. В случае избытка ионов водорода (в кислой среде) они будут активнее «вырывать» гидроксид-ионы из осадка, тем самым смещая равновесие в сторону растворенной формы, повышая растворимость осадка. Также стоит упомянуть, что весь пищеварительный тракт человека имеет кислую среду: pH желудочного сока колеблется от 1 до 2. Отклонение от этих значений в меньшую или большую сторону может являться признаком различных заболеваний. 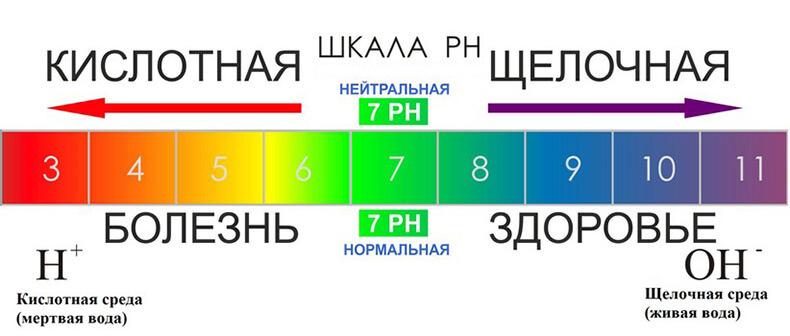
Свойства щелочной среды
В щелочной среде водородный показатель принимает значения, превышающие 7. Для удобства в средах с высокой концентрацией гидроксид-ионов вместо водородного показателя кислотности pH пользуются показателем основности pOH. Нетрудно догадаться, что он обозначает величину, равную — lg[OH-] (отрицательный десятичный логарифм концентрации гидроксид-ионов). Непосредственно из ионного произведения воды следует равенство pH + pOH =14. Поэтому pOH = 14 — pH. Таким образом, у всех утверждений, верных для показателя кислотности pH, верны обратные утверждения для показателя основности pOH. Если pH щелочной среды большой по определению, то ее pOH, очевидно, маленький, и чем сильнее раствор щелочи, тем меньше показатель pOH. В этом предложении только что появился логический парадокс, вносящий путаницу во многие рассуждения о кислотности: маленький показатель кислотности обозначает высокую кислотность среды, и наоборот: большие значения pH соответствуют низкой кислотности. Этот парадокс появляется потому, что логарифм берется со знаком минус, и шкала кислотности как бы инвертируется.
Практическое определение кислотности
Для определения кислотности среды применяются так называемые индикаторы. Обычно это достаточно сложно устроенные органические молекулы, которые меняют свой цвет в зависимости от pH среды. Индикатор меняет свой цвет в очень узком интервале pH: это используется в кислотно-основном титровании, чтобы добиться точных результатов: титрование прекращают, как только индикатор меняет цвет. Наиболее известные индикаторы — метиловый оранжевый (интервал перехода в области с маленьким pH), фенолфталеин (интервал перехода в области с большим pH), лакмус, тимоловый голубой и другие. В кислых средах и щелочных средах применяются разные индикаторы в зависимости от того, в какой области лежит их интервал перехода. Существуют также универсальные индикаторы — они меняют свой цвет постепенно с красного на глубоко фиолетовый при переходе из сильно кислотных сред в сильно щелочные. На самом деле универсальные индикаторы представляют собой смесь из обычных.  Для более точного определения кислотности используют прибор — pH-метр (потенциометр, метод, соответственно, называется потенциометрия). Его принцип работы основан на измерении ЭДС в цепи, элементом которой является раствор с измеряемым pH. Потенциал электрода, погруженного в раствор, чувствителен к концентрации ионов водорода в растворе — отсюда изменение ЭДС, на основании которого рассчитывается реальный pH.
Для более точного определения кислотности используют прибор — pH-метр (потенциометр, метод, соответственно, называется потенциометрия). Его принцип работы основан на измерении ЭДС в цепи, элементом которой является раствор с измеряемым pH. Потенциал электрода, погруженного в раствор, чувствителен к концентрации ионов водорода в растворе — отсюда изменение ЭДС, на основании которого рассчитывается реальный pH. 
Кислотность различных сред в быту
Показатель кислотности имеет большое значение в повседневной жизни. Например, слабые кислоты — уксусная, яблочная — используются в качестве консервантов. Щелочные растворы являются моющими средствами, в том числе и мыло. Самое простое мыло представляет собой натриевые соли жирных кислот. В воде они диссоциируют: остаток жирной кислоты — очень длинный — с одной стороны имеет отрицательный заряд, а с другой своей стороны — длинную неполярную цепочку атомов углерода. Тот конец молекулы, на котором заряд участвует в гидратации, собирает вокруг себя молекулы воды. Второй конец присоединяется к другим неполярным вещам, например, молекулам жира. В результате образуются мицеллы — шарики, у которых наружу торчат «хвосты» с отрицательным зарядом, а внутри спрятаны «хвосты» и частички жира и грязи. Поверхность отмывается от жира и грязи за счет того, что моющее средство связывает весь жир и грязь в такие мицеллы.
Кислотность и здоровье
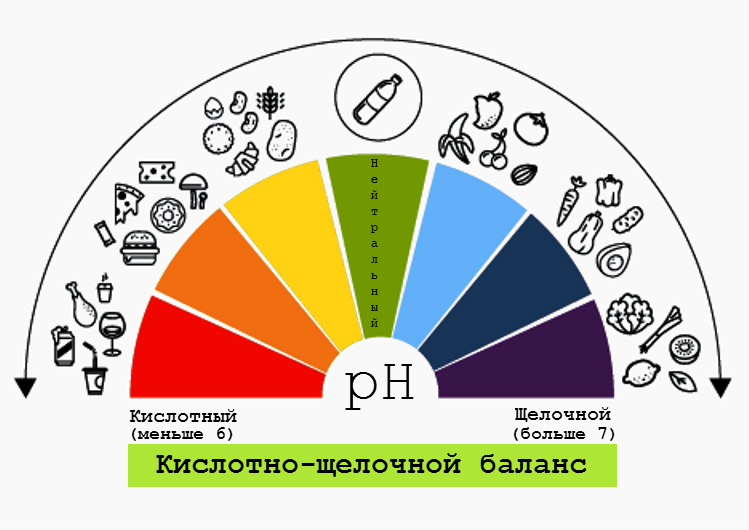 Уже было упомянуто, что pH имеет большое значение для человеческого организма. Кроме пищеварительного тракта, показатель кислотности важно контролировать и в других частях организма: кровь, слюна, кожа — для многих биологических процессов имеют большое значение кислая среда и щелочная среда. Их определение позволяет оценить состояние организма. Сейчас набирают популярность pH-тесты — так называемые экспресс-тесты для проверки кислотности. Они представляют собой обычные полоски универсальной индикаторной бумаги.
Уже было упомянуто, что pH имеет большое значение для человеческого организма. Кроме пищеварительного тракта, показатель кислотности важно контролировать и в других частях организма: кровь, слюна, кожа — для многих биологических процессов имеют большое значение кислая среда и щелочная среда. Их определение позволяет оценить состояние организма. Сейчас набирают популярность pH-тесты — так называемые экспресс-тесты для проверки кислотности. Они представляют собой обычные полоски универсальной индикаторной бумаги.